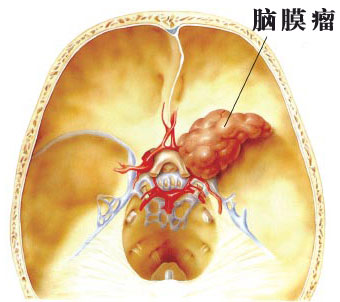
桥小脑角肿瘤对一般患者可能感到陌生,但对医学上尤其是对于神经鞘膜瘤(听神经瘤,听神经鞘瘤),其特征性症状是耳鸣,单侧性听力障碍以及有时候发生的眩晕.如果肿瘤较大,对邻近的颅神经,脑干与小脑产生压迫,可引起角膜反射消失,面肌瘫痪,面部感觉消失,软腭无力,小脑功能障碍的体征,以及罕见的对侧偏瘫或偏身感觉减退.如能及早作MRI检查,能在肿瘤扩大并压迫邻近的颅神经与脑组织之前就被诊断出来.对外耳道冷热水刺激的前庭反应的消失,脑成像扫描上见到的内听孔的扩大,以及脑脊液蛋白定量的增高都提示听神经瘤。
 手术入路与体位 :
手术入路与体位 :
CPA脑膜瘤的手术体位一般采用侧卧位,头架固定头部。根据肿瘤生长方向来决定手术入路。我们认为选择一个正确的手术入路,原则上应符合以下要求:①到达病变的距离近;②对脑组织的牵拉很小;③能获得肿瘤各部分很好的显露,尤其是肿瘤与重要神经组织或血管界面的显露;④手术入路中神经和血管的阻挡很少;⑤术者对该手术入路非常熟悉。本组69例采取枕下乳突后入路,因该手术入路解剖显露良好,且距CPA区近,肿瘤与脑干显示较清楚,可在直视下保护瘤周重要神经和血管,对肿瘤单纯位于CPA或以CPA为主累及斜坡者,肿瘤全切比例和面、听神经保存比例较高,缺点是术野较窄。另12例肿瘤已侵犯天幕向幕上生长而采用幕上下联合入路,一次手术完成幕上下肿瘤切除。
减少术中出血 :
CPA脑膜瘤接受颈动脉和椎基动脉系统双重供血,肿瘤血供丰富,术中出血较多。由于该部位术前进行栓塞比较困难,我们多采用术中控制性低血压的方法来减少出血。控制性低血压是在控制呼吸和大量吸氧的情况下,通过神经节阻断药物降低周围血管阻力和对心肌的抑制作用,使末梢小动脉扩张,减少周围有效循环血量,使收缩压下降至90 mmHg,必要时可降至70~80 mmHg,但不低于60 mmHg,可维持1~2 h,不会导致脑缺氧,术后无不良反应。在控制性低血压的情况下,术中能明显减少出血,本组对大小在3.5 cm 以上的肿瘤术中采用控制性低血压均收到较好的效果。
显微手术切除肿瘤:
本组采用侧卧位病侧枕下乙状窦后入路开颅,此入路的优点是术中不必过分牵拉小脑,而且对后组脑神经的暴露和保护均较容易。枕下骨窗以显露瘤蒂部硬膜为度。小脑前下动脉分支是脑干和肿瘤的主要供血,术中应熟悉其分支及走向,显微镜下严格沿瘤壁与蛛网膜之间分离,推开附着于瘤壁上的血管,确认进入瘤体内的小血管才可电凝切断,切勿轻易切断较大径的血管以免损伤小脑前下动脉的主干。小脑前下动脉损伤或逆行性血栓形成是CPA区肿瘤手术死亡的重要原因,应尽力避免。质地柔软的肿瘤易吸除,质地坚韧或血运丰富的肿瘤切除较困难。为减少巨大肿瘤术中对小脑半球的过度牵拉和保护肿瘤周围正常的神经和血管,可行小脑半球外1/3切除,以免过度牵拉损伤脑组织,然后在囊内行肿瘤分块切除,降低囊内压力,逐步缩小瘤体,再分离肿瘤包膜和神经、血管,这样可减少术后并发症。本组术中行小脑外1/3切除18例,术后均恢复良好。在切除脑干旁肿瘤时嘱麻醉师保留病人自主呼吸,同时注意病人呼吸和心比例的变化,一旦出现血压、呼吸、心跳异常应立即暂停手术,待恢复正常后再继续进行。当肿瘤较大或出血较多,肿瘤与脑干、神经等重要组织黏连明显,难以切除时,宁可残留瘤壁或部分肿瘤,不可强求全切。
脑干及穿支血管保护 :
小脑前下动脉及其分支是脑干和肿瘤的重要供血来源,在分离肿瘤时容易损伤供应脑干的动脉分支,导致术后脑干出血、水肿或同侧脑桥梗死。因此,我们认为在分离肿瘤时应尽量靠近肿瘤侧分离处理供应肿瘤的动脉。术中切忌牵拉脑干,如果脑干与肿瘤黏连太紧,任何试图强行分离肿瘤的操作均将导致不可挽回的后果。在这种情况下宁愿残留部分肿瘤在脑干表面,术后病人尚有良好的生存质量。本组1例病人在术中分离脑干表面肿瘤时出血较多,导致术后脑干水肿和出血,病人终因呼吸循环衰竭而死亡。因此,在分块切除肿瘤时,要避免过分牵拉肿瘤,对于脑干表面的出血,一般不用电凝止血 (动脉性出血除外),常用明胶海绵加脑棉轻压,或用止血纱布止血效果更好。
神经和血管的保护 :
面、听神经常位于肿瘤的腹侧,由于肿瘤挤压,使其被拉长而变细变色。后组脑神经位于肿瘤下极,沿岩骨侧壁走向颈静脉孔区,这些脑神经在肉眼下有时难以辨别,一旦损伤,可出现严重并发症。文献报告CPA脑膜瘤切除面神经保留比例为60%~100%,听力保留比例为48%~87%。脑神经保护好坏与否是评价手术治疗结果的重要因素,因此,术中很理想的方法是在神经电生理的监测下进行肿瘤分离,才能减少术中脑神经的损伤。本组19例采用面、听神经刺激仪确认面、听神经,从内听道侧逆行或脑干侧顺行逐步向对侧汇合,在剥离肿瘤过程中逐渐将面、听神经分离出来。但解剖保留面、听神经并不意味着术后其功能的保留。面神经即使解剖保留完整,有些病人术后仍有不同程度的功能障碍。本组面、听神经的解剖保留比例为77.7%,功能保留比例为46.9%,我们分析原因可能如下:①手术时损伤供应听神经的血管或术后供应面神经的血管栓塞导致面神经的缺血性损害;②因肿瘤压迫面神经致其功能受损,术中牵拉加重了损害。为避免面、听神经的进一步损伤,我们体会术中应注意以下几点:①分离面、听神经与肿瘤时,应牵拉肿瘤而不是面、听神经;②坚持锐性分离;③不要过分牵拉小脑以避免间接牵拉面、听神经;④尽可能保留面、听神经的血供;⑤避免电凝的热损伤。超声吸引可用于肿瘤的囊内切除,但一定要慎重,避免穿透肿瘤囊壁而损伤面、听神经。对于术中面神经断裂者,神经端端吻合是理想的挽救方式;若术中不能进行端端吻合,应早期采用面神经-舌下神经或副神经吻合术改善面瘫症状,前者的总体临床效果优于后者,应作为治疗。本组术中面神经断裂后实施面神经端端吻合2例,术后1年随访,1例病人的面瘫症状恢复较好,House-Brackmann分级Ⅲ级,另1例病人恢复不理想。
肿瘤复发的处理:
较大或质地较硬的肿瘤常不能达到全切除,而导致术后复发。文献报道CPA脑膜瘤术后复发的可能达9.5%,本组术后复发的可能为6.15%,低于文献报道。我们的体会是:在保护面、听神经功能的前提下,尽可能做到全切除肿瘤,是减少肿瘤复发的重要因素。关于复发性脑膜瘤,特别是复发的大型脑膜瘤,治疗仍为手术治疗。对于不能完全切除和术后复发的体积较小 (直径小于3 cm) 的CPA脑膜瘤,可选择γ-刀治疗。本组4例复发肿瘤均采用再次手术切除,由于再次手术时组织黏连明显,全切除困难,术中仅行肿瘤部分或大部切除,残留肿瘤术后行γ-刀治疗。近年来我们对术后有残留肿瘤的病人均建议行γ-刀治疗,在近3年多的随访中未见肿瘤复发。

CPA脑膜瘤的手术体位一般采用侧卧位,头架固定头部。根据肿瘤生长方向来决定手术入路。我们认为选择一个正确的手术入路,原则上应符合以下要求:①到达病变的距离近;②对脑组织的牵拉很小;③能获得肿瘤各部分很好的显露,尤其是肿瘤与重要神经组织或血管界面的显露;④手术入路中神经和血管的阻挡很少;⑤术者对该手术入路非常熟悉。本组69例采取枕下乳突后入路,因该手术入路解剖显露良好,且距CPA区近,肿瘤与脑干显示较清楚,可在直视下保护瘤周重要神经和血管,对肿瘤单纯位于CPA或以CPA为主累及斜坡者,肿瘤全切比例和面、听神经保存比例较高,缺点是术野较窄。另12例肿瘤已侵犯天幕向幕上生长而采用幕上下联合入路,一次手术完成幕上下肿瘤切除。
减少术中出血 :
CPA脑膜瘤接受颈动脉和椎基动脉系统双重供血,肿瘤血供丰富,术中出血较多。由于该部位术前进行栓塞比较困难,我们多采用术中控制性低血压的方法来减少出血。控制性低血压是在控制呼吸和大量吸氧的情况下,通过神经节阻断药物降低周围血管阻力和对心肌的抑制作用,使末梢小动脉扩张,减少周围有效循环血量,使收缩压下降至90 mmHg,必要时可降至70~80 mmHg,但不低于60 mmHg,可维持1~2 h,不会导致脑缺氧,术后无不良反应。在控制性低血压的情况下,术中能明显减少出血,本组对大小在3.5 cm 以上的肿瘤术中采用控制性低血压均收到较好的效果。
显微手术切除肿瘤:
本组采用侧卧位病侧枕下乙状窦后入路开颅,此入路的优点是术中不必过分牵拉小脑,而且对后组脑神经的暴露和保护均较容易。枕下骨窗以显露瘤蒂部硬膜为度。小脑前下动脉分支是脑干和肿瘤的主要供血,术中应熟悉其分支及走向,显微镜下严格沿瘤壁与蛛网膜之间分离,推开附着于瘤壁上的血管,确认进入瘤体内的小血管才可电凝切断,切勿轻易切断较大径的血管以免损伤小脑前下动脉的主干。小脑前下动脉损伤或逆行性血栓形成是CPA区肿瘤手术死亡的重要原因,应尽力避免。质地柔软的肿瘤易吸除,质地坚韧或血运丰富的肿瘤切除较困难。为减少巨大肿瘤术中对小脑半球的过度牵拉和保护肿瘤周围正常的神经和血管,可行小脑半球外1/3切除,以免过度牵拉损伤脑组织,然后在囊内行肿瘤分块切除,降低囊内压力,逐步缩小瘤体,再分离肿瘤包膜和神经、血管,这样可减少术后并发症。本组术中行小脑外1/3切除18例,术后均恢复良好。在切除脑干旁肿瘤时嘱麻醉师保留病人自主呼吸,同时注意病人呼吸和心比例的变化,一旦出现血压、呼吸、心跳异常应立即暂停手术,待恢复正常后再继续进行。当肿瘤较大或出血较多,肿瘤与脑干、神经等重要组织黏连明显,难以切除时,宁可残留瘤壁或部分肿瘤,不可强求全切。
脑干及穿支血管保护 :
小脑前下动脉及其分支是脑干和肿瘤的重要供血来源,在分离肿瘤时容易损伤供应脑干的动脉分支,导致术后脑干出血、水肿或同侧脑桥梗死。因此,我们认为在分离肿瘤时应尽量靠近肿瘤侧分离处理供应肿瘤的动脉。术中切忌牵拉脑干,如果脑干与肿瘤黏连太紧,任何试图强行分离肿瘤的操作均将导致不可挽回的后果。在这种情况下宁愿残留部分肿瘤在脑干表面,术后病人尚有良好的生存质量。本组1例病人在术中分离脑干表面肿瘤时出血较多,导致术后脑干水肿和出血,病人终因呼吸循环衰竭而死亡。因此,在分块切除肿瘤时,要避免过分牵拉肿瘤,对于脑干表面的出血,一般不用电凝止血 (动脉性出血除外),常用明胶海绵加脑棉轻压,或用止血纱布止血效果更好。
神经和血管的保护 :
面、听神经常位于肿瘤的腹侧,由于肿瘤挤压,使其被拉长而变细变色。后组脑神经位于肿瘤下极,沿岩骨侧壁走向颈静脉孔区,这些脑神经在肉眼下有时难以辨别,一旦损伤,可出现严重并发症。文献报告CPA脑膜瘤切除面神经保留比例为60%~100%,听力保留比例为48%~87%。脑神经保护好坏与否是评价手术治疗结果的重要因素,因此,术中很理想的方法是在神经电生理的监测下进行肿瘤分离,才能减少术中脑神经的损伤。本组19例采用面、听神经刺激仪确认面、听神经,从内听道侧逆行或脑干侧顺行逐步向对侧汇合,在剥离肿瘤过程中逐渐将面、听神经分离出来。但解剖保留面、听神经并不意味着术后其功能的保留。面神经即使解剖保留完整,有些病人术后仍有不同程度的功能障碍。本组面、听神经的解剖保留比例为77.7%,功能保留比例为46.9%,我们分析原因可能如下:①手术时损伤供应听神经的血管或术后供应面神经的血管栓塞导致面神经的缺血性损害;②因肿瘤压迫面神经致其功能受损,术中牵拉加重了损害。为避免面、听神经的进一步损伤,我们体会术中应注意以下几点:①分离面、听神经与肿瘤时,应牵拉肿瘤而不是面、听神经;②坚持锐性分离;③不要过分牵拉小脑以避免间接牵拉面、听神经;④尽可能保留面、听神经的血供;⑤避免电凝的热损伤。超声吸引可用于肿瘤的囊内切除,但一定要慎重,避免穿透肿瘤囊壁而损伤面、听神经。对于术中面神经断裂者,神经端端吻合是理想的挽救方式;若术中不能进行端端吻合,应早期采用面神经-舌下神经或副神经吻合术改善面瘫症状,前者的总体临床效果优于后者,应作为治疗。本组术中面神经断裂后实施面神经端端吻合2例,术后1年随访,1例病人的面瘫症状恢复较好,House-Brackmann分级Ⅲ级,另1例病人恢复不理想。
肿瘤复发的处理:
较大或质地较硬的肿瘤常不能达到全切除,而导致术后复发。文献报道CPA脑膜瘤术后复发的可能达9.5%,本组术后复发的可能为6.15%,低于文献报道。我们的体会是:在保护面、听神经功能的前提下,尽可能做到全切除肿瘤,是减少肿瘤复发的重要因素。关于复发性脑膜瘤,特别是复发的大型脑膜瘤,治疗仍为手术治疗。对于不能完全切除和术后复发的体积较小 (直径小于3 cm) 的CPA脑膜瘤,可选择γ-刀治疗。本组4例复发肿瘤均采用再次手术切除,由于再次手术时组织黏连明显,全切除困难,术中仅行肿瘤部分或大部切除,残留肿瘤术后行γ-刀治疗。近年来我们对术后有残留肿瘤的病人均建议行γ-刀治疗,在近3年多的随访中未见肿瘤复发。
* 温馨提示:本院案例真实有效,只供业内专业人士研究使用,不作为用药指导和对患者的承诺保障。
上一篇:脑垂体瘤有什么方法治疗? 下一篇:脑瘤遗传吗?